2024年11月27日,浙江大学医学院附属第二医院邱福铭教授团队在专注于肿瘤研究的期刊《Frontiers in Oncology》上发表了一篇题为Case report: Prolonged benefit of ESG401, a Trop2 antibody drug conjugate, in endocrine refractory hormone receptor positive, HER-2 negative metastatic breast cancer的论文:

原文链接:
https://www.frontiersin.org/journals/oncology/articles/10.3389/fonc.2024.1444431/full
该文章报告了一例内分泌耐药激素受体阳性、HER2阴性转移性乳腺癌患者的病例,这例患者接受ESG401治疗,截至2024年5月撰稿时,患者已持续获益23.6个月。
摘要
乳腺癌(BC)仍然是女性癌症相关死亡的主要原因之一,其中激素受体阳性(HR+)肿瘤占据了很大比例。尽管内分泌治疗(ET)取得了一定进展,但在转移性阶段,耐药依然是一个重大挑战。研究表明,内分泌治疗联合使用细胞周期蛋白依赖性激酶4/6(CDK4/6)抑制剂可显著提高患者的生存率。然而,在中国,当患者对CDK4/6抑制剂(CDK4/6i)产生耐药或因经济原因无法使用该类药物时,化疗通常成为标准治疗。这表明,针对CDK4/6i治疗后耐药的患者,迫切需要开发更为有效的治疗方案。ESG401是一种新型靶向Trop2的抗体偶联药物(ADC),其临床前及早期临床研究结果显示出良好的安全性与疗效。本文报道了一例61岁女性HR+/HER2-转移性乳腺癌(MBC)患者,该患者对氟维司群及后续化疗均产生了耐药,但在接受ESG401治疗后,获得了持续超过22.5个月的部分缓解(PR)。此病例凸显了以Trop2为靶点的ADC(如ESG401)在克服内分泌耐药方面的潜力,同时为经过多线治疗的HR+/HER2- MBC患者提供了显著的临床获益。此外,该患者的长期临床获益在接受ESG401治疗的患者中尤为突出。建议通过扩大临床试验进一步研究ESG401在HR+/HER2- MBC患者中的应用,并深入探讨影响其长期疗效的患者特征。
1. 引言
乳腺癌是全球最常诊断的癌症之一,约占2020年所有新发癌症病例的24.5%,也是女性癌症相关死亡的主要原因之一。激素受体阳性(HR+)肿瘤占乳腺癌病例的70-80%。由于乳腺肿瘤的发生和发展高度依赖于雌激素-雌激素受体(ER)轴,雌激素抑制疗法和ER拮抗剂已成为HR+HER2-转移性乳腺癌的主要治疗手段。然而,并非所有患者都对内分泌治疗(ET)表现出良好的治疗效果。ET的原发性和继发性耐药仍然是治疗中的重大挑战。
研究表明,ET与细胞周期蛋白依赖性激酶4/6(CDK4/6)抑制剂联合使用可有效克服ET耐药,并显著延长患者的生存时间。此外,PIK3CA抑制剂、mTOR抑制剂、AKT抑制剂以及新兴的口服选择性雌激素受体降解剂(SERDs)等作为后续治疗方案,也逐渐受到关注。然而,在中国,这些治疗手段的可及性仍然有限。当患者已用尽基于ET的治疗选择时,单药化疗通常成为标准治疗方法。然而,晚期化疗的疗效有限,患者生活质量下降,且伴随显著的毒副作用,进一步凸显了这一患者群体中未满足的医疗需求。
ESG401是一种新型的抗体偶联药物(ADC),由靶向Trop2的人源化IgG1单克隆抗体与拓扑异构酶I抑制剂SN-38通过具有专利的稳定-可裂解连接子相连,其药物与抗体的比值(DAR)为8。一项针对局部晚期或转移性实体瘤患者的I/II期研究初步结果显示,ESG401在经过多线治疗的患者中具有良好的安全性、耐受性和显著的治疗效果。本文报告了一例HR+/HER2- MBC患者,该患者对氟维司群存在原发性耐药,并接受了多次化疗,但在接受ESG401治疗后获得了持续超过22个月的显著缓解。目前,该患者仍在接受治疗,并表现出良好的疗效和耐受性。
2. 病例描述
该例61岁女性患者于2019年10月因胸部CT检查发现多发肺结节前来我院就诊。5年前,她被诊断为小叶性乳腺癌(Luminal B型),并接受了改良根治性乳腺切除术。术后进行了辅助化疗(表柔比星联合环磷酰胺和多西他赛),并持续接受来曲唑作为辅助内分泌治疗直至此次就诊。患者有哮喘病史,但控制良好。体格检查未发现明显症状或阳性体征。胸部CT显示多发肺结节、双侧胸膜结节增厚及纵隔淋巴结肿大(图1A、B)。经支气管内超声引导下的纵隔淋巴结经支气管针吸活检证实为雌激素受体阳性(ER+)、孕激素受体阴性(PR-)、HER2 2+/荧光原位杂交阴性的乳腺癌复发(图1C-G)。未发现脑部、骨骼及腹部转移。最终诊断为转移性小叶性乳腺癌(肺、淋巴结及胸膜转移)。

曾建议患者接受基于CDK4/6抑制剂的内分泌治疗,但因经济原因,患者当时拒绝该治疗。随后改用氟维司群(一种选择性雌激素受体降解剂)治疗。然而,3个月后复查CT显示肺结节显著增大,并发现新的肝脏肿块(图2),提示对内分泌治疗的原发性耐药。此后,患者接受了9个周期的白蛋白结合型紫杉醇(200 mg,每21天的第1天和第8天静脉注射)作为二线治疗,取得部分缓解(PR),并转为卡培他滨维持治疗,无进展生存期(PFS)为13.6个月。接着以艾日布林(2 mg,每21天的第1天和第8天静脉注射)作为三线治疗,再次取得部分缓解(PR),并用艾日布林维持治疗达14.7个月。2022年5月,肝转移病灶进展(图2)。
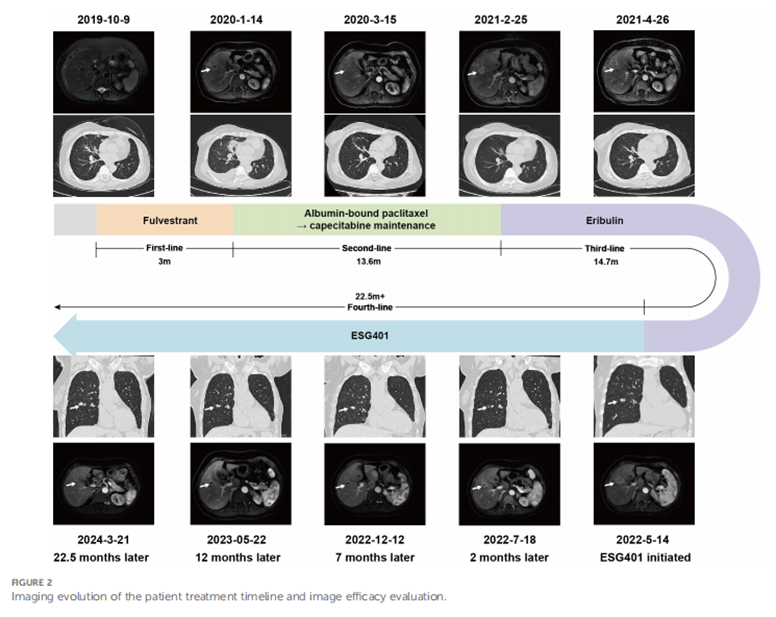
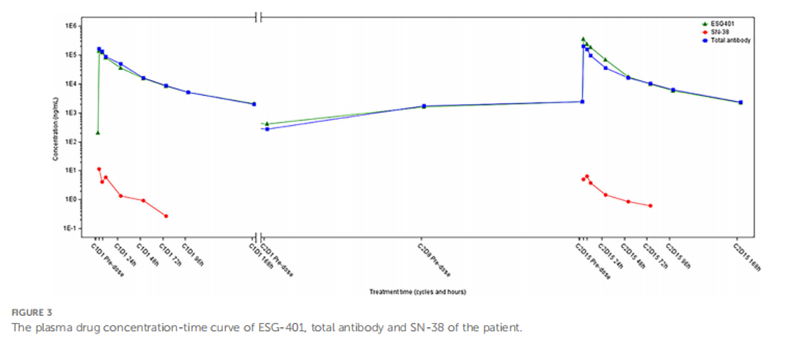
患者的东部肿瘤协作组(ECOG)活动状态为1。随后被推荐参加一项评估ESG401(上海诗健生物科技有限公司)安全性及抗肿瘤效果的I/II期临床试验(NCT04892342)。ESG401是一种新型的抗体偶联药物(ADC),由靶向Trop2的人源化IgG1抗体与小分子药物SN-38(一种拓扑异构酶I抑制剂)通过创新的稳定可裂解连接子相连,药物与抗体比值(DAR)为8。在签署知情同意书后,患者于2022年5月25日开始接受ESG401治疗(12 mg/kg,每28天的第1天、第8天和第15天静脉注射)。免疫组化检测显示Trop2 H评分为250,为高表达水平(图1H)。经过两个治疗周期后,CT显示肝转移病灶从33 mm显著缩小至17 mm(缩小48.5%),根据RECIST 1.1标准评估为部分缓解(PR)。四周后再次确认PR。此后,患者病灶进一步缩小,靶病灶最长直径总和的总体缩小比例达到52.6%。截至2024年5月撰稿时,患者已持续获益23.6个月。2024年3月21日的最新CT扫描显示肝转移病灶仍维持PR,尽管一个肺结节有所增大,但整体疗效评估仍为PR。药代动力学分析显示,无论单次还是多次给药,患者血浆中的总抗体和完整ADC浓度均保持一致。然而,与总抗体和ESG401相比,SN-38的浓度显著低,其血药峰浓度(Cmax)为6.5 ng/ml,曲线下面积(AUC)为136 ng·h/ml。总抗体和ADC药物的药代动力学特征高度相似,表明了ESG401在体循环中非常稳定(图3)。在ESG401治疗期间,患者仅出现轻微且易于管理的不良反应,包括2级中性粒细胞减少、1级腹泻和贫血。患者的整体表现状态良好,生活质量较高。
3. 讨论
内分泌耐药是指对雌激素或ER抑制的耐药,仍然是治疗HR+/HER2-乳腺癌患者面临的重大难题。对于转移性乳腺癌,原发性内分泌耐药定义为在一线内分泌治疗(ET)治疗的前6个月内疾病进展。其机制复杂,可能与雌激素受体通路的改变(例如,ESR1突变)或生长因子上游信号通路(例如PI3K/Akt/mTOR通路)有关。过去20年中,针对ER和上游信号通路的新药物开发和批准取得了显著进展。在中国,对于使用过芳香化酶抑制剂(AIs)后进展的患者,CDK4/6抑制剂与氟维司群联合使用是标准治疗。在本案例中,患者因经济原因未选择CDK4/6抑制剂治疗,并在接受氟维司群单药治疗时迅速进展。除化疗外,mTOR抑制剂依维莫司与依西美坦联合使用是一个有利的选择,可能延长对非甾体AI耐药患者的无进展生存期(PFS)。然而,依维莫司的毒性较高限制了其使用。尽管目前在中国尚未上市,但PI3K和AKT抑制剂在激活PI3K/AKT/mTOR通路的HR+/HER2-乳腺癌患者中显示出改善预后的潜力,为克服内分泌耐药提供了替代策略。
抗体偶联药物(ADCs)是一类靶向治疗,由单克隆抗体与细胞毒药物结合而成。单克隆抗体组分能够特异性识别并结合肿瘤细胞表面抗原,而细胞毒药物载荷直接对肿瘤细胞施加强效的抗肿瘤作用。恩美曲妥珠单抗(T-DM1)是第一个获批的靶向HER2的ADC。与T-DM1相比,另一种靶向HER2的ADC德曲妥珠单抗(T-DXd)在HER2阳性MBC患者中显示出更好的生存改善;对于低HER2表达的MBC患者,与标准化疗相比,其也显著提高了生存率。Trop2是乳腺癌中的另一个有潜力的靶点。其最早在1981年被发现,是一种主要存在于滋养层细胞表面的蛋白。然而,后续研究发现其在肿瘤细胞包括生长、增殖、迁移、侵袭和生存等过程中具有重要的作用。在乳腺癌中,Trop2基因的表达在所有亚型中均有发现,在HR+HER2阴性和三阴性乳腺癌(TNBC)中尤为显著,而在HER2阳性疾病中相对较低。高水平的Trop2表达与更差的生存结局相关。
戈沙妥珠单抗(SG)是第一个靶向Trop2的ADC,最近在中国被批准用于接受过两种或更多线化疗的转移性三阴性乳腺癌(mTNBC)患者。SG由人源化抗Trop2单克隆抗体通过可水解的CL2A连接子与SN-38连接。另一种靶向Trop2的ADC Dato-DXd通过可裂解的四肽连接子将人源化抗Trop2 IgG1单克隆抗体与拓扑异构酶I抑制剂结合,其DAR值为4。尽管这三种药物均为靶向Trop2的ADC,但它们在分子组成上存在一定差异。表1中提供了这三种药物的比较。
在对内分泌治疗耐药的HR+/HER2- MBC患者中,戈沙妥珠单抗显著提高了中位无进展生存期(mPFS)(5.5个月对比4.0个月)和中位总生存期(mOS)(14.4个月对比11.2个月),优于传统化疗。然而,安全性分析显示,SG组中不良事件(AEs)的发生率较高,特别是中性粒细胞减少、腹泻、恶心、呕吐、脱发和疲劳。CL2A连接子因设计用于细胞外水解,导致游离SN-38在循环中更早释放,导致更高的毒性浓度暴露,可能加重AEs。相比于研究者选择的化疗, Dato-DXd在HR+/HER2- MBC的III期临床试验中显著改善了PFS(6.9个月对比4.9个月),并表现出良好的安全性。这些研究表明,以Trop2为靶点的ADC作为一种新型治疗方法,对HR+/HER2- MBC展现出了巨大的潜力。
一个理想的ADC连接子应具有足够的稳定性以便将载荷运输到目标部位,同时也应表现出足够的活性,以便在肿瘤或肿瘤微环境(TME)内释放足够量的药物。ESG401是一种针对Trop2的新型ADC,其采用创新的稳定可裂解连接子,将SN-38与靶向Trop2的人源化单克隆抗体结合,DAR值为8。在ESG401的设计中,由于连接子的稳定性增加,完整ADC分子在体内循环中不太容易解离,从而降低了游离药物的系统暴露。研究显示,与SG相比,该例患者体内完整ADC的半衰期更长(49.0小时对比23.4小时),而SN-38的暴露量更低,这从SN-38与ADC的比值(0.002%对比0.07%)中得以体现。此外,与SG已发表的药代动力学数据相比,该患者及其他试验患者的药代动力学评估表明,SN-38的最大浓度(Cmax,6.5 ng/ml对比98.0 ng/ml)及曲线下面积(AUC,136 ng·h/ml对比3696 ng·h/ml)均显著降低。这些药代动力学特征表明,ESG401在体内循环中更稳定。这可能从机制上解释了该患者较轻的不良反应,如中性粒细胞减少、恶心和腹泻。如所报道的,ESG401的毒性反应中等,最常见的3级及以上治疗相关不良事件(TRAEs)为白细胞减少(29%)和中性粒细胞减少(31%)。未出现3级及以上的血小板减少、腹泻、皮疹或口腔黏膜炎事件。该临床试验的试验方案中提供了管理潜在不良事件(AEs)的详细指南,包括干预阈值以及由于毒性需要进行的剂量调整(补充表1)。
这种毒性特征是由于ESG401具有专利的连接子赋予ADC分子更高的稳定性,并减少了系统中游离药物的释放,从而最小化了非靶向毒性而产生的。可裂解连接子和膜渗透性载荷SN-38使其能够产生“旁观者效应”。在临床前动物模型中,与接受SG治疗相比,接受ESG401治疗的模型动物肿瘤内游离SN-38和总SN-38的水平更高且暴露时间更长。减少的在血清中的释放和肿瘤组织内SN-38的暴露增加,表明了ESG401在动物模型中表现出可靠的疗效和卓越的安全性。I/II期临床试验的初步结果评估了ESG401在局部晚期或转移性实体瘤患者中的安全性、耐受性、药代动力学和抗肿瘤效果。共有35名接受过多线治疗的患者(中位治疗线数为4 [2-10])被纳入研究。在33名疗效可评估的患者中,各种剂量方案下的客观缓解率(ORR)和疾病控制率(DCR)分别为36.4%(12/33)和63.6%(21/33)。具体到接受治疗相关剂量的HR+/HER2- MBC患者亚组(13名患者),ORR和DCR分别为62%(8/13)和77%(10/13)。这些疗效信号表明ESG401对HR+/HER2- MBC具有良好的治疗效果,这与我们报告的此例患者表现出的超长临床获益是一致的。此外,目前正在开展一项ESG401与研究者选择化疗(ICC)的开放性、随机、活性对照、多中心III期研究(NCT06383767)。该试验招募了在内分泌治疗期间进展、不适合内分泌治疗并已接受至少一种系统性化疗的HR+/HER2-局部晚期或转移性乳腺癌患者。研究旨在通过在更大患者群体中验证本病例研究的发现。在本病例中,患者在氟维司群治疗期间迅速进展,随后接受了两种化疗方案。在接受ESG401治疗后,患者达到了显著的部分缓解(PR),且该缓解持续超过22.5个月,表现出极好的耐受性和良好的生活质量。该缓解时长不仅超过了之前化疗所能达到的持续时间,还显著长于使用SG(5.5个月)和Dato-DXd(6.8个月)治疗相同适应症患者的、已发表的中位无进展生存期(mPFS)。这种持久的缓解可能归因于ADC带有细胞毒载荷的独特作用机制,这种机制可能不受传统内分泌治疗耐药机制的影响。其他可能的促成因素包括Trop2的高表达(H评分:250)。在ASCENT试验中,Trop2高表达患者的总生存(OS)趋势性更佳。此外,较低的肿瘤负荷、良好的活动状态以及ESG401表现出的良好疗效也可能对治疗获益产生了积极影响。同时,可能还存在其他未揭示的潜在因素影响了治疗效果。进一步探索这些因素将有助于更深入地了解药物的作用机制,并为类似患者的治疗提供有意义的指导。此外,该患者的肝脏和肺部病灶对ESG401治疗表现出不同的响应,这突显了肿瘤的异质性。已有报道,在乳腺癌的不同转移部位中,Trop2表达具有异质性。在疾病进展(PD)开始时,通过肺部转移病灶的重新活检进行分析,可能为ESG401的耐药机制提供宝贵的提示,从而指导后续的治疗策略。此外,该患者的HER2状态为2+,靶向HER2的ADC药物德曲妥珠单抗(T-DXd)可能成为一个替代治疗选择。在DESTINY-Breast04试验中,与医生选择的化疗相比,T-DXd在低HER2表达的晚期乳腺癌中显著改善了PFS和OS。
本病例研究的局限性包括:该例患者未接受过CDK4/6抑制剂治疗,而CDK4/6抑制剂已成为治疗Luminal样转移性乳腺癌的重要治疗基石。由于经济原因和个人选择,患者当时未接受CDK4/6抑制剂治疗。在该例患者参加的这项临床试验(NCT04892342)中,65名HR+/HER2-患者中有78%曾接受过CDK4/6抑制剂治疗。在58名疗效可评估的患者中,曾接受过CDK4/6抑制剂治疗患者的ORR为27.7%,而未接受过CDK4/6抑制剂治疗患者的ORR为54.5%(未发表的内部数据)。这些结果来源于回顾性分析,可能受基线不均衡和样本量较小的影响,因此尚不清楚此前使用CDK4/6抑制剂是否会影响ESG401的疗效。此外,该患者未再接受分子检测,因此无法确定她是否适合其他靶向治疗(如PIK3CA/AKT/mTOR抑制剂)。需要进一步研究,以探索基因靶向治疗与Trop2 ADCs在更大患者队列中的潜在相互作用。另一个重要的局限是,尽管患者在超过22.5个月的ESG401治疗期间仅经历了轻微且易于管理的不良反应(包括2级中性粒细胞减少、1级腹泻和贫血),但本I期研究未包括标准化的生活质量评估或患者报告结果(PRO)测量。因此,患者生活质量的改善尚未得到客观验证。在计划中的III期研究中,生活质量评估将作为次要终点之一。
结论
对于内分泌耐药的HR+/HER2- MBC患者,靶向Trop2的ADC是后续治疗的理想选择。提升ADC设计有望最大化这些药物的疗效和安全性。ESG401在经过多线治疗的患者中展现出良好的耐受性,并显示出极具希望的疗效信号。建议开展更大样本量的针对HR+/HER2- MBC患者的临床试验以进一步研究ESG401,并深入了解可能影响长期疗效的患者特征。