2025年12月7日,诗健生物在第67届ASH会议上以Poster形式报告了ESG206(抗BAFF-R单抗)治疗复发/难治性原发免疫性血小板减少症 I/II期临床研究的最新数据。
研究题目:Interim Report of a Phase 1/2 Study of ESG206 in Patients with Refractory or Relapsed Primary Immune Thrombocytopenia.
研究背景:
阻断BAFF-R信号通路并清除表达BAFF-R的B细胞或可为免疫性血小板减少症(ITP)患者带来临床获益。ESG206是一种经过糖基化改造(去岩藻糖基化)的重组人源化抗BAFF-R的单克隆抗体,一方面可直接靶向作用于 B 细胞表面表达的 BAFF-R,通过增强的ADCC(Antibody Dependent Cell-mediated Cytotoxicity,抗体依赖的细胞介导的细胞毒性作用)发挥作用。另一方面,可阻断BAFF与BAFF-R的结合。该药物在复发/难治性B细胞恶性肿瘤中已显示出良好的疗效和耐受性,目前正针对ITP适应症开展研究。本报告呈现了正在开展的ESG206治疗复发/难治性原发性ITP患者(试验编号NCT06853444)I期研究的初步安全性、药代动力学、药效学及疗效数据。
研究方法:
该研究的I期阶段为开放、多中心、剂量递增研究。入组既往至少接受过皮质类固醇治疗且血小板计数<30×10⁹/L的原发性ITP患者。受试者每4周静脉注射一次ESG206(剂量为1、3、6或9 mg/kg),共给药4次。若受试者合并使用皮质类固醇和/或血小板生成素受体激动剂,则需在首次ESG206输注前至少14天内剂量保持稳定。研究主要目的是评估安全性和耐受性。次要终点包括药代动力学、药效学及疗效指标,例如(完全)缓解率、确认(完全)缓解率、至缓解时间以及持续缓解率。患者将在首次输注后接受为期24周的随访,以评估缓解持久性。
研究结果:
截至2025年10月23日,共12例受试者接受了至少一剂ESG206治疗(中位年龄[范围]为40[25-72]岁;其中3名男性[25%])。受试者既往接受ITP治疗线数中位数为4(范围1-9)。其中7例受试者接受ESG206单药治疗,3例联合使用皮质类固醇(CS)、1例联合血小板生成素受体激动剂(TPO-RA)、1例联合使用CS与TPO-RA作为背景治疗。
治疗期间,共有10例受试者(83%)报告不良事件,其中大部分为1-2级且呈一过性。治疗相关不良事件包括皮疹(1例,3级)、上呼吸道感染(1例,1级)及贫血(1例,1级)。无患者因不良事件终止治疗。
截至数据截止日,受试者的最长观察期为154天。5例受试者(42%)达到缓解(定义为血小板计数≥50×10⁹/L且评估前至少4周内未接受解救治疗,且在确认缓解前未接受其他ITP治疗)。其中3例受试者(25%)达到确认缓解(在至少间隔7天的两次及以上评估中血小板计数均≥50×10⁹/L)。5例受试者(42%)达到完全缓解(血小板计数≥100×10⁹/L且未接受解救治疗)。在缓解受试者中,达到缓解的中位时间(范围)为7(7-21)天。

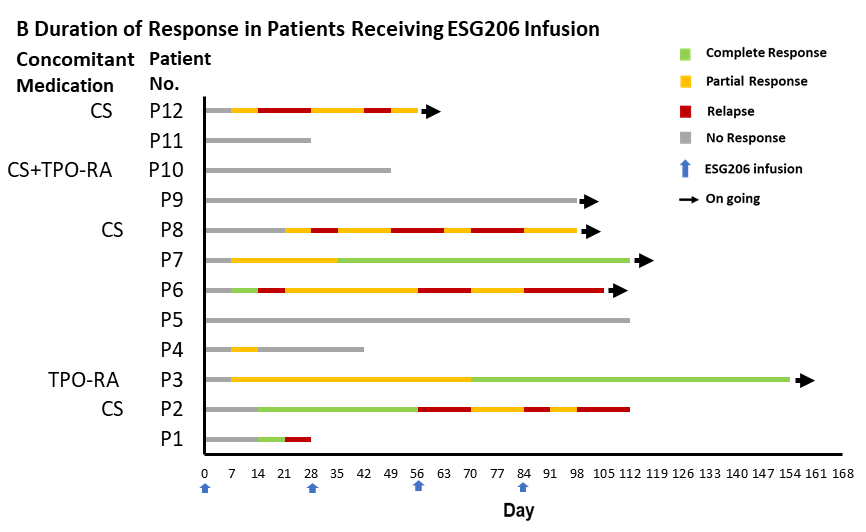
图1. ESG206输注后的血小板计数变化与缓解持续时间
图A展示了所有12例受试者的血小板计数中位值。图中横线表示四分位距,实线代表100×10⁹/L的血小板计数阈值,虚线代表50×10⁹/L的血小板计数阈值。图B为个体缓解持续时间的泳道图。图中对完全缓解、部分缓解、无缓解和复发的定义如下:完全缓解:定义为血小板计数至少达到100×10⁹/L且无出血。部分缓解:定义为血小板计数至少达到30×10⁹/L,且较基线计数至少增加两倍,同时无出血。未缓解:定义为血小板计数低于30×10⁹/L,或低于基线计数的两倍,或存在出血。复发:定义为在达到缓解后出现以下任何一种情况:血小板计数低于30×10⁹/L,或低于基线计数的两倍,或存在出血。图中同时标注了是否合并使用血小板生成素受体激动剂(TPO-RAs)或皮质类固醇(CS)。
亮点总结:
这是ESG206在原发性免疫性血小板减少症患者中的首次研究数据披露。初步研究结果显示,即使在经多线治疗的复发/难治性ITP患者中,ESG206单药治疗方案也已展现出快速且令人鼓舞的疗效,并具有良好的耐受性特征。这些早期的分析结果为在ITP患者中进一步开展ESG206的临床探索提供了支持。同时,ESG206治疗多项自身免疫性疾病的临床研究均在探索中,其中原发性干燥综合征的Ⅱ期临床试验正在启动,治疗系统性红斑狼疮等适应症的临床试验也在计划中。
ESG206在ASH会议壁报展示的poster原文如下:
